N6-甲基腺嘌呤(N6-methyladenosine, m6A)作为真核生物mRNA上含量最丰富的化学修饰之一,几乎参与了所有转录后调控过程,包括RNA的剪接、加工、转运、降解及翻译等。相关领域的前期研究表明:在胚胎干细胞(Embryonic Stem Cells,ESCs)中敲除m6A甲基转移酶METTL3会引起全转录组范围甲基化水平下调并导致ESCs分化障碍,从而提示m6A修饰在早期胚胎发育中发挥着十分重要的作用。然而,METTL3敲除引起了数千个位点的甲基化水平的改变。METTL3敲除导致的ESCs分化缺陷是由单一位点RNA甲基化事件引起的,还是由多个m6A修饰位点协同作用引起的?单个m6A位点修饰的改变是否足以决定细胞命运?由于在ESCs中缺乏对单个m6A修饰进行精确调控的工具,这些科学问题仍未被阐明。为了研究特定m6A位点的功能,当前常用的方法是在基因组水平上引入点突变,进而永久性地去除特定m6A位点。然而,在ESCs分化的过程中m6A修饰高度动态变化,引入永久性m6A位点突变不能实现m6A修饰的动态可逆调控,并可能引起无法预测的生物学影响。到目前为止,适用于研究ESCs中特定m6A位点修饰对细胞命运影响的系统尚未被建立。
2021年3月18日,中山大学中山医学院曹楠课题组及生命科学学院骆观正课题组在Advanced Science期刊上发表了题为Targeted RNA N6-Methyladenosine Demethylation Controls Cell Fate Transition in Human Pluripotent Stem Cells 的论文,在人ESCs(hESCs)中开发了对特定m6A位点甲基化水平进行精确可逆调控的新工具TRME(Targeted RNA m6A Erasure),并利用其探究了单位点m6A对hESCs命运决定的影响。

研究团队首先在体外将无核酸切割活性的RNA靶向蛋白dCas13a和m6A去甲基化酶ALKBH5的催化结构域相融合,构建了细胞核及细胞质定位的靶向性m6A去甲基化蛋白dCas13a-ALK。随后该团队利用受强力霉素诱导调控的piggyBac转座子系统将dCas13a-ALK融合蛋白和靶向crRNA整合至hESCs基因组中,从而得到能够通过加入和去除强力霉素灵活可逆调控特定m6A位点甲基化水平的hESC细胞系。研究团队进一步以hESCs中m6A修饰程度较高的SOX2等一系列基因为研究对象,证明了胞质定位的TRME工具不仅能够精准调控特定m6A位点去甲基化,而且可以通过抑制YTHDF2介导的RNA降解过程增加靶基因mRNA的稳定性和表达水平。而核定位TRME介导的单个m6A位点去甲基化则抑制了新生mRNA的核质转运,进而引起胞质mRNA和靶基因蛋白表达水平的下降。最后,研究团队发现在胞质中对SOX2基因mRNA单个位点m6A修饰的擦除即可抑制hESCs向中内胚层分化,并促进其向外胚层转化,改变了hESCs的细胞分化命运。
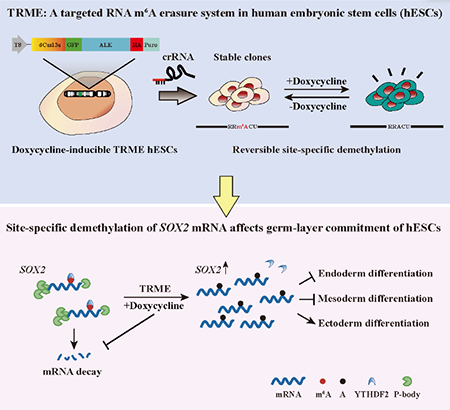
图示:hESCs单位点m6A编辑工具的建立及其在细胞命运调控研究中的应用
综上所述,该研究为解析干细胞分化机理提供了新的平台和切入点,并证明了单个m6A位点的去甲基化即足以影响干细胞命运抉择,而转录组水平的整体m6A重构并不是必须的。
博士生陈雪娜、赵清泉及赵玉丽为论文的共同第一作者。曹楠教授,骆观正教授及王嘉副研究员为论文的共同通讯作者。博士生柴国师及程维晟,以及副研究员赵志举参与了该研究。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202003902













